丂
亙栚師傊亜
丂楢嵹丂乽悈偲偼側偁偵丠乿
乣惗柦偲娐嫬偺娭傢傝偱峫偊傞乣 嘇
丂攏応丂峗懢丂乮峀搰廋摴戝妛柤梍嫵庼乯丂
俀侽侽俈擭丂俀寧丂戞俈侽崋
悈偲昘偲悈忲婥亅悈偺嶰懺曄壔
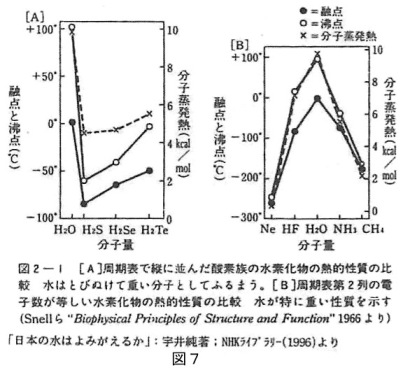
丂巹偨偪偑晛捠偵乽悈乿偲偄偆偲偒偵偼僐僢僾偵擖偭偰偄傞悈偺傛偆偵塼懱偺悈偺偙偲傪峫偊偰偄傑偡丅偟偐偟丄堦斒揑側暔幙偲偟偰偺悈偼塼懱偲偟偰偺悈丄屌懱偺巔傪偲偭偰偄傞悈亖昘丄婥懱偺巔偵側偭偨悈亖悈忲婥偲偄偆3捠傝偺婄傪帩偭偰偍傝丄廃埻偺埑椡偲壏搙偺忦審師戞偵傛偭偰3捠傝偺婄乮憡偲屇傃傑偡乯偺娫偱堏傝曄傢偭偰偄傑偡丅
丂巹偨偪偺廧傓抧媴昞柺偺娐嫬偼戝婥偺埑椡偑嘥婥埑丄暯嬒壏搙偼15亷偱偡丅偙偺娐嫬忦審偱偼忢壏偱悈偑塼懱偱偁傝丄婥懱丄屌懱偺忬懺偲偺娫偱堏傝曄傢傝側偑傜嫟懚偱偒傞偲偄偆愨柇側娭學偵側偭偰偄傑偡丄摉偨傝慜偺傛偆側偙偺偙偲偺帩偮堄枴傪夵傔偰墴偝偊偰偍偒傑偟傚偆丅
丂悈偼抧昞傪棳傟壓傝丄忲敪偟偰悈忲婥偑忋嬻傊忋傝丄塉丒愥偵側偭偰抧昞傊栠傞偲偄偆弞娐傪偟偰偄傑偡丅偦偺夁掱偱悈偺棳傟偼廃傝偺暔偺擬傪傛偔媧廂偟偰壏搙偺曄壔傪彫偝偔偟側偑傜塣傃丄昘乕悈亅悈忲婥偺嶰懺曄壔傪捠偟偰擬偺棳傟傪岠棪傛偔庴偗搉偟偡傞偲偄偆摥偒偵傛偭偰娐嫬偺壏搙曄壔傪榓傜偘偰偄傑偡丅偦偟偰偦傟偲摨帪偵悈偼偁傜備傞暔幙傪傛偔梟偐偟塣傃丄悈偺棳傟偼娐嫬拞偺暔偺棳傟丄惗柦懱偺暔幙弞娐偺棳傟傪巟偊偰偄傑偡丅
丂偙偺傛偆偵丄悈偼懠偺暔幙偵斾傋偰嵺棫偭偰斾擬偑戝偒偄丄婥壔擬偑戝偒偄丄暔幙偺梟夝擻椡偑戝偒偄偙偲丄昘偑悈偵晜偔偙偲側偳丄悈偺摿幙偵偮偄偰偼慜夞偵怗傟偰偒傑偟偨偑丄偦偺懠偵丄悈偼昞柺挘椡偑懠偺暔幙傛傝丄悈嬧傪彍偒旘傃敳偗偰戝偒偄偲偄偆摿幙傕偁傝傑偡丅
丂悈偑帵偡偙傟傜偺摿堎側惈幙偼壗偵傛偭偰偄傞偺偐丄崱夞偼悈偺慺惈傪悈偺暘巕偺峔憿偐傜尒偰偄偔偙偲偵偟傑偟傚偆丅彮偟偩偗嵶偐偄榖偵側傞偐傕偟傟傑偣傫偑丄尨巕傗暘巕偺悽奅偺寢傃偮偒曽傕丄恖娫偲恖娫偺寢傃偮偒曽偺娭學偲堷偒斾傋偰峫偊偰傒傞偙偲偑偱偒偰寢峔柺敀偄傕偺偱偡丅
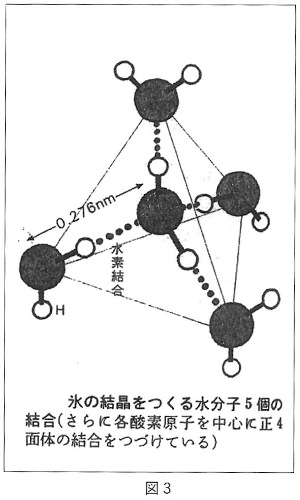
丂悈偺暘巕俫2俷偺宍偺旈枾
丂亄偲亅偺嬌傪帩偮暘巕
丂悈偺暘巕偼H2O偲彂偒昞偝傟傞傛偆偵丄巁慺尨巕俷偵悈慺尨巕俫偑俀屄偔偭偮偄偨傕偺偱偡丅偟偐偟丄偦偺偔偭偮偒曽偵娭偟偰偼H2O偲彂偄偨偩偗偱偼暘偐傝傑偣傫偑丄幚偼偦偺宍偑戝曄廳梫側偺偱偡丅
丂悈偑帵偡偄偔偮傕偺摿堎側惈幙偺場偭偰偔傞尦偼丄傑偢戞堦偵丄巁慺尨巕俷偲俀偮偺悈慺尨巕俫偑寢傃偮偄偰偄傞宍偑恾俆偵偁傞傛偆偵乽偔乿偺帤宆傪偟偰偄傞偙偲偵偁傝傑偡丅
丂堦斒揑偵尨巕偺帩偮揹巕偼俀屄偢偮偱儁傾傪慻傫偱偄傑偡偑丄儁傾傪慻傓憡庤偺偄側偄揹巕傪帩偮俀偮偺尨巕摨巑偑揹巕傪弌偟崌偄丄揹巕偺儁傾傪慻傫偱埵抲僄僱儖僊乕揑偵埨掕偟偨忬懺偱嫟桳偟偰堦偮偺暘巕偵側傞丄偲偄偆寢傃偮偒曽偑偁傝丄嫟桳寢崌偲屇傃傑偡丅
丂恾俆偱巁慺尨巕俷偲悈慺尨巕俫傪寢傫偱偄傞懢偄慄偼丄悈慺尨巕俫偺揹巕侾屄偑巁慺尨巕俷偺傕偮揹巕偺拞偺儁傾傪慻傫偱偄側偄揹巕偺憡庤偺嬻惾偵擖傝丄偱偒偨揹巕偺儁傾傪巁慺尨巕俷偲悈慺尨巕俫偑嫟桳偟偰寢傃偮偄偰偄傞偙偲傪昞偟偰偄傑偡丅乮巁慺尨巕偼拞怱偵偁傞尨巕妀偺廃傝傪俉屄偺揹巕偑媴忬偵埻傫偱夞偭偰偄傑偡偑丄昞柺嬤偔偺揹巕偺婳摴偵偼儁傾傪慻傓傋偒嬻惾傪帩偮揹巕偑俀慻偁傝傑偡丅偙傟偵懳偟偰悈慺尨巕偼拞怱偵偁傞尨巕妀偺廃傝傪揹巕偑侾屄偩偗偱媴忬偵埻傫偱夞偭偰偄傑偡丅乯
丂悈偺暘巕偼恾俆偺傛偆偵丄巁慺尨巕俷偼俀偮偺悈慺尨巕俫偲偺娫偱偦傟偧傟侾屄偢偮偺揹巕傪嫟桳偡傞偙偲偱寢崌偟偰偄傑偡丅
丂偙偺偙偲偼悈慺尨巕俫偐傜尒傞偲丄亅偺揹婥傪帩偮揹巕傪巁慺尨巕俷偺懁偵曃傜偣傞偙偲偱尨巕妀偺亄揹婥偲偺娫偺僶儔儞僗偑曃偭偰丄悈慺尨巕俫偺懁偱偼亅偺揹婥偑晄懌偡側傢偪亄揹婥傪懷傃偨偙偲偵側傝傑偡丅
丂傕偟丄俀偮偺悈慺尨巕俫偺埵抲偑丄巁慺尨巕俷傪拞怱偲偡傞捈慄忬偺傛偆側幉懳徾側埵抲偵偁傟偽丄巁慺尨巕俷偐傜尒偰亅偺揹婥傪帩偮揹巕偺堏摦偼俀偮偺悈慺尨巕偵偮偄偰斀懳曽岦偱懪偪徚偟崌偆偨傔丄巁慺尨巕俷偺埵抲偱亅偺揹婥偺曃傝偼惗偠傑偣傫丅
丂偟偐偟丄悈偺暘巕偱偼俀偮偺悈慺尨巕俫偼乽偔乿偺帤宆偺曃偭偨曽岦偵埵抲偟偰偄傞偨傔丄巁慺尨巕俷偐傜尒傞偲俀偮偺悈慺尨巕偺帩偭偰偄傞揹巕傪堷偒婑偣偨偙偲偱丄尨巕妀偺亄揹婥偲偺娫偺僶儔儞僗偑曃偭偰丄巁慺尨巕俷偱偼乽偔乿偺帪偺妏偺懁偵亅偺揹婥傪懷傃偨偙偲偵側傝傑偡丅
丂偙偺傛偆偵堦偮偺暘巕偺拞偱亄偺揹婥傪懷傃偨嬌偲亅偺揹婥傪懷傃偨嬌偲偑暘偐傟偰懚嵼偟偰偄傞暘巕偼丄帴愇偵俶嬌偲俽嬌偑偁傞偺偲帡偰偄偰丄亄偺揹婥傪懷傃偨嬌偵偼亄偺揹婥傪懷傃偨僀僆儞側偳傪堷偒偮偗傞惈幙傪帩偪丄嬌惈暘巕偲屇傃傑偡丅
丂悈偼偙偺傛偆偵嬌惈暘巕偱偁傞偙偲偺偨傔丄椺偊偽怘墫NaCl悈偱偼Na+僀僆儞偺廃傝偵悈暘巕偺亅嬌偑廤傑傝丄Cl-僀僆儞偺廃傝偵偼悈暘巕偺亄嬌偑廤傑傞偙偲偱傛偔梟偗傞傛偆偵丄悈偵偼奺庬偺僀僆儞傪巒傔條乆側暔幙偑梟偗崬傒傗偡偄偙偲偺尨場偲側偭偰偄傑偡偟丄偝傜偵偼師偵愢柧偡傞悈暘巕摨巑傗懠偺暘巕偲偺娫偵悈慺寢崌傪惗偠傞婎偲側偭偰偄傑偡丅
傑偨丄揹巕儗儞僕偱悈暘傪娷傓傕偺偑壛擬偝傟傞偺傕丄悈偑桳嬌惈偺暘巕偺宍傪偟偰偄傞偨傔偵儅僀僋儘攇偺僄僱儖僊乕傪媧廂偟偰備偡傜傟偰擬塣摦偑惙傫偵側傝壏搙偑忋偑傞偨傔偱偡丅
丂悈偺暘巕俫俀俷偺廤抍偺旈枾丂亅悈慺寢崌亅
丂恾俆偵偼俀偮偺悈偺暘巕H2O偑昤偄偰偁傝傑偡偑丄塃偺H2O暘巕偺俷偺亅揹婥偲丄嵍偺H2O暘巕偺俫偺亄揹婥偲偺娫偵偼庛偄揹婥揑堷椡偑摥偒丄偙偺堷椡偱塃偺H2O暘巕偲嵍偺H2O暘巕摨巑偑寢傃偮偒偁偭偰偄傑偡丅偙偺椡偵傛傞寢傃偮偒曽偼揰慄偱帵偟偰偁傝悈慺寢崌偲屇偽傟傑偡丅
丂悈慺寢崌偺嫮偝偼幚慄偱帵偝傟偰偄傞嫟桳寢崌偺嫮偝偺侾乛侾侽埲壓偱丄巁慺尨巕俷偲悈慺尨巕俫偺娫偺嫍棧偼丄嫟桳寢崌偱偼傎傏0.1nm偱偁傞偺偵懳偟偰悈慺寢崌偱偼偞偭偲0.2nm偲側偭偰偄傑偡丅乮nm偼僫僲儊乕僩儖丄0.1nm偼侾壄暘偺1cm乯
丂嫟桳寢崌偑尨巕偲尨巕傪寢傃偮偗偰暘巕傪嶌傞傎偳偺嫮偝傪帩偮寢崌偱偁傞偺偵懳偟偰丄悈慺寢崌偼暘巕偲暘巕傪庛偔寢傃晅偗傞摥偒傪偟傑偡丅庛偄偲偼尵偭偰傕丄偄傠偄傠側暔幙偺暘巕傪嬅廤偝偣偰偄傞堦斒偺暘巕娫椡偵斾傋傟偽偢偭偲嫮偄傕偺偱偡丅
丂悈慺寢崌偼悈偺応崌偵尷傞傕偺偱偼側偔丄堦斒偵揹巕傪庢傝崬傒傗偡偄巁慺側偳偺尨巕偲寢傃偮偄偰彮偟亄揹婥傪懷傃偨悈慺偲丄揹巕傪庢傝崬傒傗偡偔亅揹巕傪懷傃偨暿偺尨巕偲偺娫偵摥偔揹婥揑側堷椡偱偡丅椺偊偽惗柦忣曬偱偁傞俢俶俙偺2杮偺嵔偼墫婎懳偺悈慺寢崌偵傛偭偰寢傃偮偄偰偄傑偡丅
丂偲傕偁傟悈傪峫偊傞忋偱悈慺寢崌偼嬌傔偰廳梫偱丄悈偺帩偮摿堎側惈幙偺懡偔偵偼悈慺寢崌偑娭傢偭偰偄傑偡丅塼懱偺悈偺拞偱偼丄H2O暘巕偼悈慺寢崌偵傛偭偰悢屄偐傜廫悢屄丄偁傞偄偼傕偭偲懡悢屄偺H2O暘巕偲偮側偑傝偁偭偰懚嵼偟偰偄傞偲峫偊傜傟偰偄傑偡丅
丂
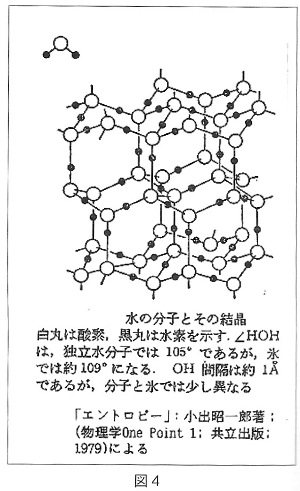
昘偺寢徎峔憿傪嶌傞悈慺寢崌
丂昘偺寢徎偱偼丄恾俁傪尒偰偄偨偩偒傑偡偲丄昘偺寢徎偺婎杮扨埵偲側偭偰偄傞惓係柺懱偺拞怱偵偁傞H2O暘巕偵帵偝傟傞傛偆偵丄侾偮偺悈暘巕偵偮偄偰係偮偺悈慺寢崌傪捠偟椬傝崌偆係偮偺悈暘巕偲寢崌偟偰偄傞偙偲偑夝傝傑偡丅
丂偡側傢偪拞怱偺崟娵偺巁慺尨巕俷偼丄惓巐柺懱偺係偮偺捀揰偵埵抲偟偰偄傞椬傝崌偆係偮偺巁慺尨巕俷偲偺娫偱丄偦偺偆偪偺2屄偺巁慺尨巕俷乮忋偲塃庤慜乯偲偼偦傟偧傟帺屓偺嫟桳寢崌偺悈慺尨巕俫傪夘偟偰悈慺寢崌偟丄巆傝偺2屄乮嵍偲塃墱乯偲偼偦傟偧傟憡庤偺嫟桳寢崌偟偰偄傞悈慺尨巕俫傪夘偟偰悈慺寢崌偟偰偄傞丄偲偄偆傛偆偵尒傞偙偲偑弌棃傑偡丅
丂偙偺娭學偼昘偺寢徎偺拞偺偳偺1屄偺悈暘巕H2O傪偲偭偰峫偊偰傕摨偠偙偲偑尵偊傞偙偲丄偮傑傝懳徧惈偺偁傞埨掕側娭學偺峔憿偩偲偄偆偙偲偱偡丅
丂偙偺傛偆偵椬傝崌偆悈暘巕H2O偲偺寢崌偑係偮偺悈慺寢崌偵傛偭偰偄傞偙偲偍傛傃丄侾偮偺扨埵偺悈暘巕偺宍偑恾俆偺傛偆偵乽偔乿偺帤宆偱偦偺奐偒偺妏搙偑104.5搙偱偁傞偙偲偺偨傔偵丄悈偺寢徎偼恾係偺傛偆側寗娫偺懡偄峔憿偵側偭偰偄傑偡丅
丂昘偺寢徎偱偼寢徎慡懱偺扨埵偺H2O偑慡偰悈慺寢崌傪捠偟偰寢偽傟偰偄傑偡偑丄昘偺寢徎偲偄偊偳傕丄奺乆偺尨巕偑姰慡偵搥傝偮偄偰屌掕偟偰偄傞栿偱偼寛偟偰側偔丄偦偺帪偺壏搙側傝偵偳偺巁慺尨巕俷傕偳偺悈慺尨巕俫傕晄婯懃偵梙傜偓怳摦偟偰偄傑偡丅
丂悈側偳偺寢徎亖屌懱偼偦傟傪峔惉偟偰偄傞奺乆偺尨巕丒暘巕偺憡懳揑側慜屻嵍塃忋壓偺埵抲娭學偑曄傢傜偢偵屌掕偟偰偄傞傕偺偱偡偑丄偦偺屌掕偟偨埵抲娭學傪曐偪側偑傜忢偵儔儞僟儉晄婯懃側塣摦傪偟偰偄傑偡丅
丂壏搙偲偄偆偺偼偦偺傛偆側屄乆偺塣摦僄僱儖僊乕偺廤崌慡懱偺暯嬒抣傪帵偡巜昗偱偡偐傜丄昘偺壏搙偑忋偑傝丄悈慺尨巕俫偺塣摦偑妶敪偵側偭偰偄偔偲丄偁偪偙偪偱悈慺寢崌偑愗傟巒傔丄偩傫偩傫悈偺暘巕偑偽傜偽傜偵側傝丄壗屄偐偺悈慺寢崌偼晹暘揑偵偮側偑偭偨傑傑偱峔憿偑曵傟偰偄偒傑偡偑丅彫偝偔僶儔僶儔偵側偨悈暘巕偑巆偭偰偄傞寢徎偺寗娫偵擖傝嬻娫傪杽傔偰偄偔偙偲偵側傝傑偡丅
丂偦偺偨傔偵懱愊偼尭傝丄0亷偐傜4亷傑偱偺娫偼丄壏搙偑忋偑傞偲偲傕偵枾搙偑憹偡偲偄偆丄懠偺暔幙偵偼尒傜傟側偄悈偵摿桳偺堎忢側尰徾偑婲偙傞偲偄偆栿偱偡丅
丂悈偼扨弮偵H2O偱偼側偄丂亅悈偺暘巕僋儔僗僞乕亅
丂
丂塼懱偲偄偆偺偼屌懱偲堘偭偰丄奺乆偺尨巕丒暘巕偑梕愊嬻娫偺拞偱慜屻嵍塃忋壓偺尨巕丒暘巕偲徴撍傪孞傝曉偟偰丄憡懳揑側埵抲娭學傪懇敍偝傟偢帺桼偵曄偊側偑傜丄儔儞僟儉晄婯懃側塣摦傪偟偰偄傑偡丅
丂偦傟偱偼昘偑梟偗偰塼懱偵側偭偨悈偼丄H2O暘巕偑偡傋偰偽傜偽傜偵側偭偰懇敍偝傟偢偵摦偒夞偭偰偄傞偺偐偲偄偆偲偦偆偄偆栿偱偼偁傝傑偣傫丅
丂悈偲偄偆塼懱偺拞偺悈暘巕偼丄悢屄乣廫悢屄傑偨偼偦傟埲忋偺屄悢偺H2O暘巕偑堦偮偵偮側偑偭偨宍偱懚嵼偟偰偄傞偲偝傟丄僋儔僗僞乕偲屇偽傟傑偡丅僋儔僗僞乕偲偄偆偺偼尦乆僽僪僂側偳偺朳偲偄偆堄枴偱偡丅
丂悈偺暘巕H2O偼悈慺寢崌偵傛偭偰梕堈偵懠偺悈暘巕H2O偲偮側偑傞偙偲偑弌棃傑偡偐傜丄昘偐傜梟偗偨悈偺拞偵壗屄傕悈慺寢崌偑偒傟偰偄側偄僋儔僗僞乕偑巆偭偰偄偰傕椙偄偟丄晄婯懃側塣摦偱傇偮偐傝側偑傜怴偨偵悈慺寢崌偑偱偒偨傝丄偮側偑偭偰偄偨悈慺寢崌偑愗傟偨傝偡傞偙偲傕偛偔帺慠側偙偲偩偲棟夝偱偒傑偡丅
丂悈暘巕偺偮側偑傝偺嬻娫揑側戝偒偝偵偮偄偰偼丄俶俵俼偵傛傞應掕側偳偺榖偑媍榑偝傟偰偄傑偡偑丄戝偒偝傪惓妋偵應傞偲偄偆偙偲偼昁偢偟傕扨弮柧椖側偙偲偱偼側偄傛偆偱偡丅
丂悈偺塼懱拞偱悈慺寢崌偼忢偵1昩娫偵侾挍夞傎偳偺妱崌偱愗傟偨傝偮側偑偭偨傝偟偰偄傞偲偄偆偙偲偱偡偐傜丄僋儔僗僞乕偲偄偆傕偺偼丄壗屄偐偺悈暘巕H2O偺偮側偑傝偑丄忢偵屌掕揑偵懚嵼偟偰偄傞偲偄偆傛偆偵懆偊傞偲娫堘偄偵側傞偱偟傚偆丅
丂
丂偟偐偟丄恾俈偵尒傜傟傞傛偆偵丄悈偼暒揰傗梈揰偺壏搙偑丄廃婜昞偱巁慺偲摨偠16懓偺尦慺偺悈慺壔暔偲斾妑偟偰旘傃敳偗偰堎忢偵崅偄偲偄偆帠幚偼丄悈偑偁偨偐傕旕忢偵廳偄暘巕偱偁傞偐偺傛偆偵傆傞傑偭偰偄傞丄偲偄偆偙偲傪帵嵈偟偰偄傞偲峫偊偰椙偄偱偟傚偆丅
丂偙偺揰偵娭楢偟偰悈偺暒摣丒婥壔丒梈夝側偳偲擬偺弌擖傝傗壏搙偵偮偄偰偺媍榑偼丄巻暆偑側偔側傝傑偟偨偺偱丄師夞偵夞偝偣偰偄偨偩偒傑偡丅
丂傑偨丄偦偺傎偐丄傑偩巆偭偰偄傞偙偲偑戲嶳偁傝傑偡偑丄悈偺昞柺挘椡偲栄娗尰徾丄偝傜偵怉暔偺岝崌惉偲悈偺忲嶶偺堄枴側偳傪埖偆梊掕偵偟偰偄傑偡丅
丂丂
丂